近日(7月14日),罗氏宣布其CD20xCD3 T细胞结合双特性癌症免疫疗法mosunetuzumab获得FDA突破性疗法认定(BTD)。
罗氏首席医学官兼全球产品开发主管Levi Garraway博士表示:“我们很高兴FDA授予mosunetuzumab突破性疗法资格,认可该分子的早期疗效数据。
这里提到的早期疗效数据来自于一项代号为GO29781的多中心I/IIb期临床研究(NCT02500407)。2019年ASH大会上,罗氏公布了该研究的临床数据。结果显示,对于事先接受过至少五线(中位)全身性治疗的难治性/复发性非霍奇金淋巴瘤患者(其中大部分对CD20疗法无应答,部分接受CAR-T治疗后复发)来说mosunetuzumab的疗效显著。
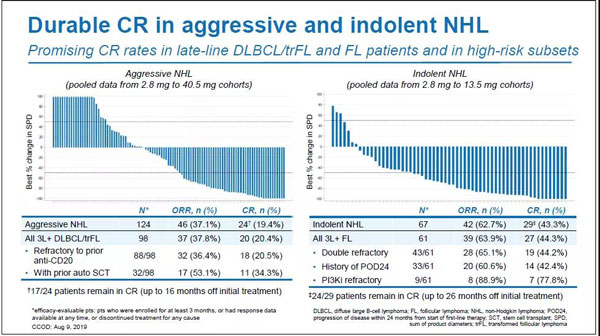
客观缓解率(ORR)方面,惰性NHL为62.7%(n=42/67)、侵袭性NHL为37.1%(n=46/124),完全缓解率(CR)方面,惰性NHL为43.3%(n=29/67),侵袭性NHL为19.4%(n=24/124)。CR持久性方面,82.8%(n=24/29)的惰性NHL患者在初始治疗后26个月内仍处于缓解状态,70.8%(n=17/24)的侵袭性NHL患者在初始治疗后16个月内仍处于缓解状态。
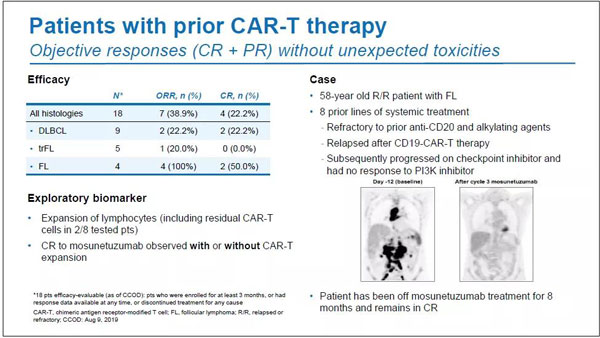
在事先接受过CAR-T疗法的亚组中,ORR和CR分别为38.9%(n=7/18)与22.2%(n=4/18)。
安全性方面,28.9%的患者出现细胞因子释放综合征(CRS),其中20.0%为1级,1.1%为3级,3级神经系统不良事件发生率为3.7%。
Mosunetuzumab
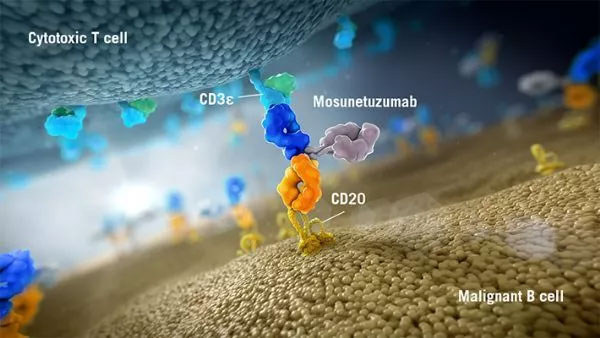
Mosunetuzumab是一款在研双特异性抗体,可以靶向B细胞表面CD20与T细胞表面CD3。这种双靶向特性可以激活和重新定向患者T细胞,接触并向B细胞释放细胞毒性蛋白。
Mosunetuzumab的结构与人天然抗体类似,有两个Fab段。但不同于天然抗体,其中一个Fab以CD20为靶点,而另一个则以CD3为靶点。目前,mosunetuzumab临床研发计划正在进行中,其目的是探索该分子作为单一或联合疗法对于CD20阳性B细胞非霍奇金淋巴瘤患者(包括滤泡性淋巴瘤,弥漫性大B细胞淋巴瘤和其他血癌)的效果。
其他相关
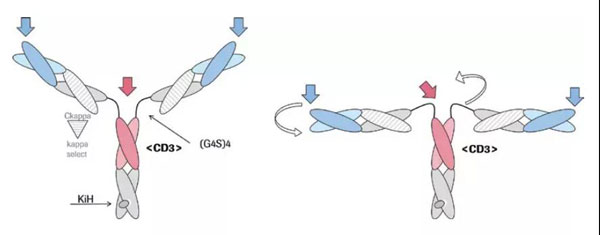
目前,罗氏在CD20靶点双抗领域具有明显优势。除了Mosunetuzumab外,罗氏另一款名为Glofitamab的CD20xCD3双特异性抗体更显特别。该抗体具有2:1 TCB结构,包含2个抗CD20的Fab和1个抗CD3的Fab。
该结构的优势在于有助于免疫突触的形成,其抗CD3和抗TAA只间隔一个CH1和CL,既保证了足够的灵活性,又保证整体大小在15nM之内,保证免疫突触的有效形成。免疫突触的形成直接影响CD3/TAA双抗的抗肿瘤活性,生理条件下TCR与MHC-多肽的结合,T细胞与肿瘤细胞的距离大概为15nm。如果CD3/TAA双抗中,TAA过大或者双抗部分过大,容易导致T细胞与肿瘤细胞的距离大于15nm,不利于免疫突触的形成。(详情请点击:罗氏三特异性抗体TriFab-Contorsbody:促进免疫突触形成)
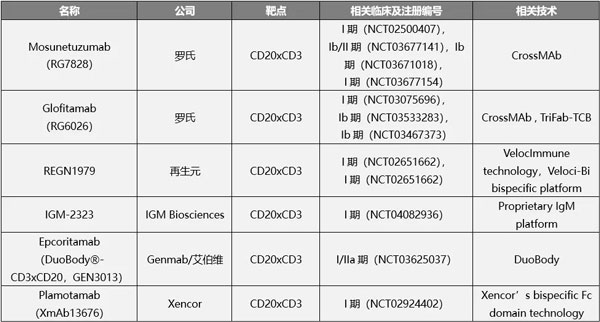
除了罗氏外,再生元,IGM Biosciences、Genmab、Xencor等公司均有CD20xCD3双抗布局。在国内,信达与罗氏达成20亿美元合作,内容包含TCB双抗,再鼎则以1.9亿美元引入再生元CD20xCD3双特异性抗体REGN1979。
在研CD20xCD3双抗


 苏公网安备32059002005708号 技术支持:苏州网站建设
苏公网安备32059002005708号 技术支持:苏州网站建设