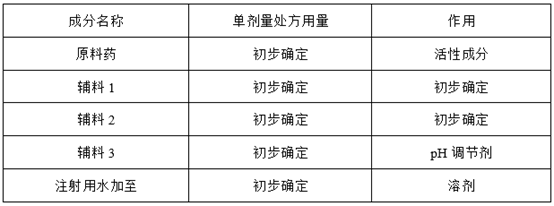
根据对原辅料物理、化学、生物学及微生物学性质的深刻理解,并参考参比制剂工艺类相关专利,设计配制工艺试验,如下:
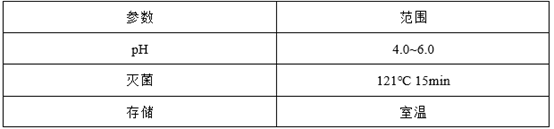
根据对参比制剂灭菌条件的查找、车间灭菌设备性能的了解、产品装量及《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》选择灭菌条件。
按下列配制工艺制备样品,灭菌后得成品,将自制产品和参比制剂和分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天,检测其性状、pH、有关物质等指标。
① :80%注射用水+辅料1+辅料2+原料药+定容+121℃15min
② :80%注射用水+辅料1+辅料2+原料药+定容+121℃20min
③ :80%注射用水+辅料1+辅料2+原料药+定容+121℃30min
注:参比制剂灭菌条件121℃15min,不同装量灭菌设备冷热点会相差约2min-10min,所以选择121℃15min、20min、30min;
1、0天,分析工艺①、②、③的理化指标有无显著差异;
2、60℃、光照、光照(带包装)10天,分析工艺①、②、③的理化指标有无显著差异;
根据得到的灭菌条件选择结果,确定不同灭菌条件的差异,依据装量选择合适灭菌条件与参比制剂进行对比,用于指导自制产品研发。
参考确定的处方信息,按处方制备样品,灭菌后得成品,将其分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天,检测其性状、pH、有关物质等指标。
1、0天,分析工艺①、②、③、④的理化指标有无显著差异,并与参比制剂对比分析;
2、60℃、光照、光照(带包装)10天,分析工艺①、②、③、④的理化指标有无显著差异,并与参比制剂对比分析;
根据得到的原辅料相容性结果,确定原辅料相容性是否良好,并参考参比制剂处方及说明书,同时依据《化学药品注射剂仿制药质量和疗效一致性评价技术要求》有关辅料种类的要求,确定自研制剂的辅料种类及数量。
根据参比制剂分析可知,本产品未冲填任何气体(氧气比例与空气一致),但为考察产品的氧敏感性,制备冲填/不冲填氮气的样品,灭菌后得成品,将其分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天,
检测其性状、pH、有关物质等指标。
1、0天,分析工艺①、②的理化指标有无显著差异,并与参比制剂对比分析;
2、60℃、光照、光照(带包装)10天,分析工艺①、②的理化指标有无显著差异,并与参比制剂对比分析;
根据得到的顶空气体选择的结果,确定冲填/不冲填氮气对产品的影响,决定是否冲填氮气。
③:80%注射用水+原料药+辅料1+辅料2 +定容
1、分析工艺①、②、③不同投料阶段及总阶段的性状、溶解时间差异。
根据得到的投料顺序选择的结果,确定最佳的投料顺序。
①:80%注射用水+辅料1+辅料2+不过筛原料药+定容
②:80%注射用水+辅料1+辅料2+过筛1原料药+定容
③:80%注射用水+辅料1+辅料2+过筛2原料药+定容
根据得到的原料药粒径选择的结果,确定最佳的原料药粒径。
根据成品pH范围、灭菌前后产品pH的变化设置中间产品pH,按处方制备样品,灭菌后得成品,将其分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天,检测其性状、pH、有关物质等指标。
①:80%注射用水+辅料1+辅料2+原料药+调pH至3.8 +定容
②:80%注射用水+辅料1+辅料2+原料药+调pH至4.0 +定容
③:80%注射用水+辅料1+辅料2+原料药+调pH至5.0 +定容
④ :80%注射用水+辅料1+辅料2+原料药+调pH至6.0+定容
⑤:80%注射用水+辅料1+辅料2+原料药+调pH至6.2+定容
注:根据成品pH范围、灭菌前后pH的变化设置中间产品pH;
1、0天,分析工艺①、②、③、④、⑤的理化指标有无显著差异,并与参比制剂对比分析;
2、60℃、光照、光照(带包装)10天,分析工艺①、②、③、④、⑤的理化指标有无显著差异,并与参比制剂对比分析;
根据得到的pH选择的结果,确定中间产品pH与成品pH的对应关系、最佳的中间产品pH及中间产品pH控制范围。
根据参比制剂包材信息及药液性质选择多个厂家包材制备样品,灭菌后得成品,将其分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天,检测其性状、pH、有关物质等指标。
1、0天,分析工艺①、②、③的理化指标有无显著差异,并与参比制剂对比分析;
2、60℃、光照、光照(带包装)10天,分析工艺①、②、③的理化指标有无显著差异,并与参比制剂对比分析;
根据得到的包材选择的结果,质量不低于参比制剂,确定最佳的包材。
①:根据配制、灌封及灯检所接触的光源,设计光源如荧光、室内自然光及日光等;
根据得到的结果,确定合适的光源、温度及时限,为放大生产提供依据。
参考《化学药品注射剂仿制药质量和疗效一致性评价技术要求》:根据溶液的特点和生产工艺进行相容性研究,研究内容包括提取研究、浸出研究、吸附和相互作用研究及安全性评价。
根据得到的结果,确定与该药品相容性是否良好,是否可安全用于该药品的生产的工艺组件。
根据溶液的特点,对所使用的过滤器进行化学兼容性和可提取物/浸出物及滤器对活性成分的吸附性相关验证。
根据得到的结果,确定与该药品相容性是否良好,是否可安全用于该药品的生产的过滤器。
采用三批原料,按处方制备样品,灭菌后得成品,将其分别置于高温(60℃)、光照(总照度1.2×106 Lux.hr,近紫外能量200μw/cm2,制剂脱包装)及光照(带包装)下考察10天、加速(40℃)下考察30天,同步考察其他光源及低温循环条件(采用1批制剂考察即可),检测其性状、pH、有关物质等指标。
注:尽可能选择不同批次的原料药,若没有,同步做三批制剂;
1、0天,分析工艺①、②、③的理化指标有无显著差异,并与参比制剂对比分析;
2、60℃、光照、光照(带包装)10天、加速(40℃)30天,其他光源及低温循环,分析工艺①、②、③的理化指标有无显著差异,并与参比制剂对比分析;
根据得到的小试三批实验结果,分析批间制剂的稳定性,并保证自研制剂质量不低于参比制剂。
本篇《注射剂项目研发生产策略全解析系列》(第八篇 小试实验设计篇)根据原辅包性质、生产工序条件,系统的设计了小试实验,得到的数据为放大生产提供依据。
1、https://db.yaozh.com/(药智数据库,很全面,90%以上的资料都有)
2、https://db.ouryao.com/(中国药典、法规及标准,查药品及检测标准等)
3、https://drugx.cn/ (药研导航,查各国药监局及药典等)
4、化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)
5、《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》
6、化学药物(原料药和制剂)稳定性研究技术指导原则