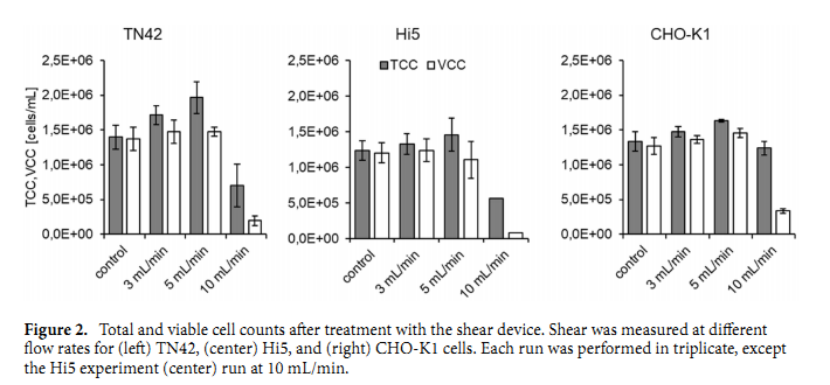
我们先看一下实验数据的分析结果,图表2可以看出无量纲剪切相关聚集不适用于这些细胞。孵育时间和剪切速率的乘积在剪切装置内是恒定的,因为在更高的流速下,孵育时间减少的量与剪切速率的增加相同。因此,只要流动条件保持层流,无量纲剪切是恒定的。但是,在更高的流速下,细胞的生存能力会下降。这种降低也表明当剪切速率超过维持恒定无量纲剪切的阈值时,就会发生细胞损伤。
接下来看一下受控剪切条件下进行的实验,看到有三种细胞系都能承受比预期高得多的剪切速率。图 2显示所有细胞系都可以承受高达 5 mL/min 的流速,这分别施加了高达 8.73 × 10 5 s -1和 5.82 × 10 5 s -1 的最大和平均剪切速率(表2)。在流速为 3 mL/min 和 5 mL/min 时 TCC 的增加可归因于细胞团块通过剪切装置的孔口时的分散。然而,由 于10 mL/min 流速施加的剪切降低了 TCC 和 VCC。此外,我们观察到 VCC/TCC 比率急剧增加。然而,在较低的剪切速率下,由于细胞团块的分散,剪切具有积极的影响;当细胞被过滤时,也会发生团块分散。
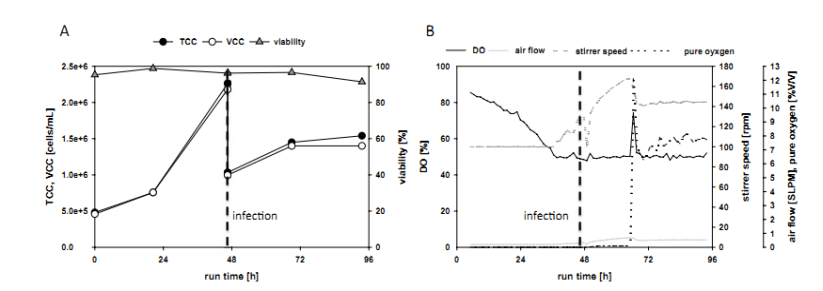
接下来研究人员又做了生物反应器的实验,主要验证之前的剪切实验结果,可以看一下A图和B图,图中TCC、VCC、viability和DO、air flow、stlrrer speed、 pure oyxgen分别表示主细胞数、活细胞数、细胞活力和溶解氧、空气流速、搅拌器的旋转速度、纯氧。在培养过程中,感染前后(虚线)和细胞活力(三角形)的总细胞数(TCC,填充符号)和活细胞数(VCC,空心符号)计数。( B ) 显示了溶解氧 (DO) 水平、气流、搅拌器速度和气流中纯氧百分比的趋势。感染的时间点由垂直粗虚线表示。在该参考实验中,细胞以 0.5 × 106细胞/mL接种并以分批模式生长,直至达到 2 × 106细胞/mL。此时,细胞以MOI为1的杆状病毒工作病毒原液感染,并用新鲜培养基稀释至1.0×106 细胞/mL(图 3A)。搅拌速度范围为100至160 rpm,对应于416 s -1和842 s -1的最大剪切速率,曝气速率范围为0.2至0.5标准升/分钟(SLPM)。结果表明,即使在细胞浓度为 1.5 × 106细胞/mL,感染后需要加入纯氧,以保持溶解氧水平在30%,避免高搅拌速度。感染导致细胞生长速度下降,感染后 48 小时之后,细胞活力降低至 91.4%。
为了在搅拌下引入更高的剪切速率,研究人员改用配备一个 Rushton 叶轮的微生物生物反应器(SR1500DLS,Eppendorf DASGIP 系统)做实验。细胞在 500 mL 批量体积中生长,搅拌速度设置为 200 rpm (883 s -1 ),作为对应于计算的 0.07 W/kg 比功率输入的起始值。气流保持在恒定的 0.016 SLPM。细胞接种于 0.5 × 106 细胞/mL 并在不添加新鲜培养基的情况下以分批模式生长 72 小时。在批量运行期间细胞活力增加,细胞密度达到4.5 × 106 个 细胞/mL(图 4A)。细胞活力不受 Rushton 叶轮产生的剪切速率的影响,甚至剪切速率以高达 270 rpm (1385 s -1 , 0.17 W/kg) 的速度运行。
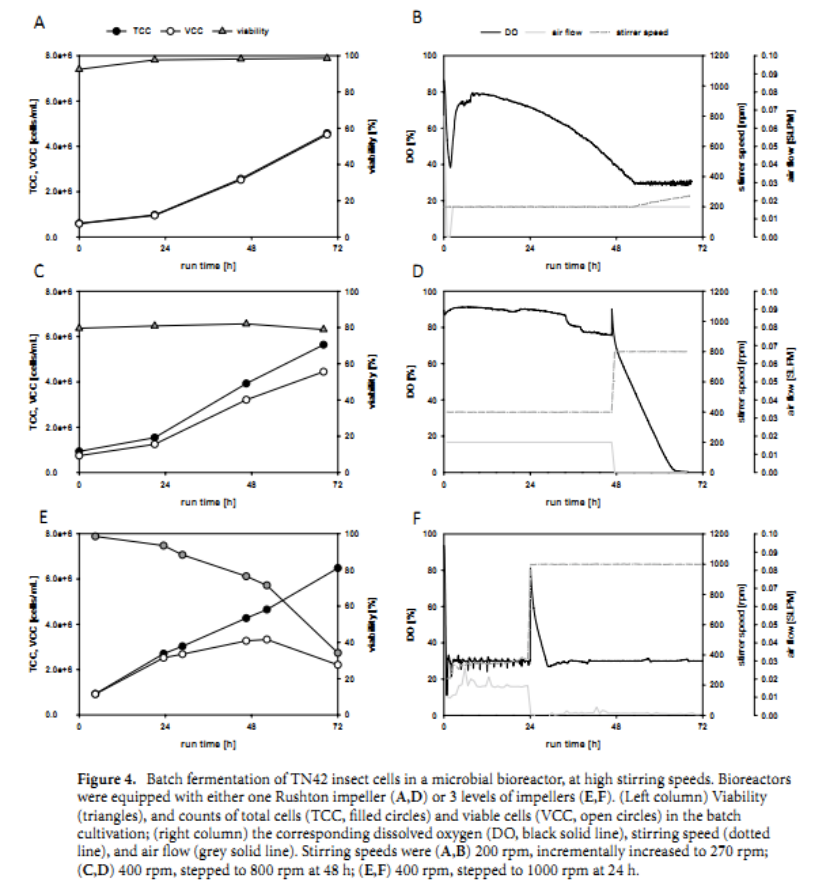
搅拌速度为 ( A , B ) 200 rpm,逐渐增加至 270 rpm;( C , D ) 400 rpm,在 48 h 时步进到 800 rpm;( E , F) 400 rpm,在 24 小时时步进到 1000 rpm。(图 4 C)以400rpm开始,以及一个步骤增加800转的48小时后培养。曝气速率设置为 0.016 SPLM 以最大限度地减少气泡和泡沫的形成,因为在该实验中没有使用消泡剂。尽管与其他批次相比,接种的细胞显示出低活力(与图4A比较),但它们的活力在前 48 小时内从 79.6% 增加到 82%。在之前的实验中也观察到了这种生存力的增加(图 4A),由此得出的结论是,由 Rushton 涡轮机以 400 rpm 提供动力的生物反应器不会影响昆虫细胞的生存能力。在最初的 400 rpm 搅拌速度和低通气速度下,DO 水平在最初的 48 小时内从 100% 缓慢下降到 65%,在此期间培养物达到 4.0 × 106细胞/mL的细胞密度。在 48 小时时,搅拌速度增加到 800 rpm,因此,在批次运行的最后 24 小时内,曝气速率设置为 0 SPLM。因此,在实验的最后几个小时内,DO 稳步下降到 0%,由于氧气有限,细胞开始死亡。另一次培养在 1 L 的工作体积下进行,但反应器配备了三个 Rushton 叶片,这是我们用于微生物培养的设置。24 小时后,将 400 rpm 的初始搅拌速度逐步提高到 1000 rpm(9872 s -1 , 8.54 W/kg)(图 4)E、F)。在此变化后 24 小时,生存力最初下降了约 5%;但在达到 1000 rpm 的步骤后 48 小时,存活率下降了 71.5%。这一观察结果可以通过高搅拌速度来解释,这导致了液体涡流的形成,因为生物反应器中没有安装挡板。结果,额外的空气通过涡流表面进入悬浮液,空气被拉什顿元件分裂成小气泡。因此,由于气泡破裂,与空气相关的细胞损伤增加。细胞无法承受这些严酷的条件。
根据前面实验中产生的信息,我们在微生物生物反应器中设置了修改后的 DO 控制策略。目的是保持尽可能低的气体流速,以最大限度地减少泡沫形成和气泡相关的剪切力。通过将搅拌速度与气流速率联系起来,调整了维持 DO 的 PID 控制策略。
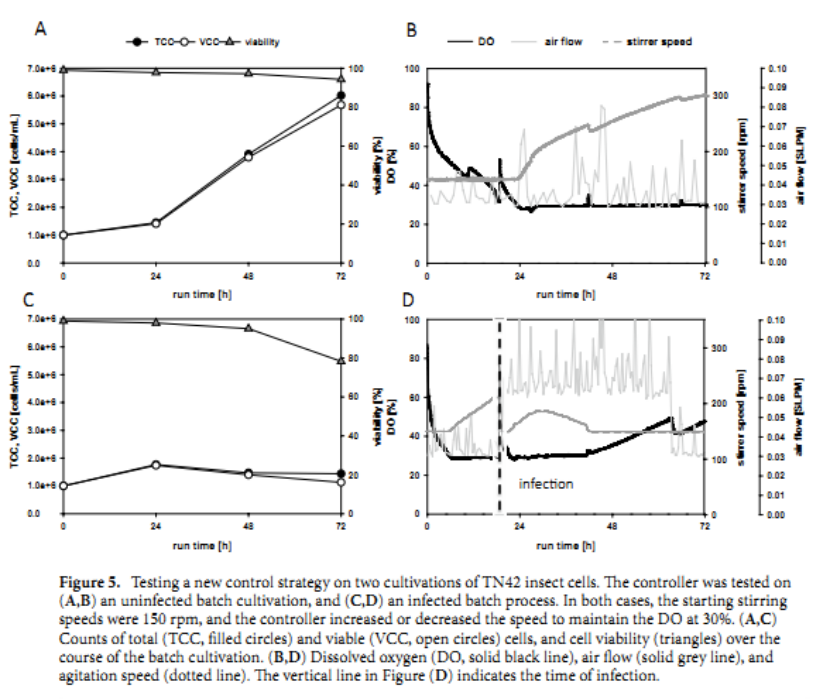
我们可以看一下图5,实验分成2组,一组是未感染细胞培养的过程,另外一组是感染细胞培养的过程。
在初始阶段,叶轮速度设置为最小值(150 rpm,574 s -1, 0.03 W/kg)。然后,当 DO 水平达到 30% 的设定点时,控制器被设置为逐渐增加搅拌速度,最高可达 800 rpm。搅拌器装有 Rushton 叶轮,L-sparger 用于分配曝气气体。在未感染细胞的培养过程中,搅拌速度增加到300 rpm(1622 s -1,0.23 W/kg),在指数生长期结束时,TCC为6×106 个细胞/mL。气体流速设置为 0.03 SLPM 的最小值,但不幸的是,控制器无法保持这个精确的流速(图 5 B、D)。在 TN42 昆虫细胞的两次培养中测试新的控制策略。控制器在 ( A , B ) 未感染的批次培养和 ( C , D ) 感染的批次过程中进行了测试。在这两种情况下,起始搅拌速度均为 150 rpm,控制器增加或降低速度以将 DO 保持在 30%。同时,在 24 小时内收到病毒感染的批次中测试了相同的过程控制策略。由于感染和VLP生产,细胞生长停止(图 5 C),但氧的消耗持续增加(图 5 d)。此外,在感染时间点,通气率增加到 0.06 SLPM。与感染批次的参考工艺(图 3)相比,在此设置中,无需添加纯氧,因为提高搅拌速度提供了有效的氧气转移。
为了确定由于搅拌速度增加引起的高剪切的影响,我们在工作体积为 500 mL 的 1.5 L 微生物 CSTR 生物反应器(SR1500DLS,Eppendorf)中以不同搅拌速度培养的两个 CHO 批次之间进行了直接比较。
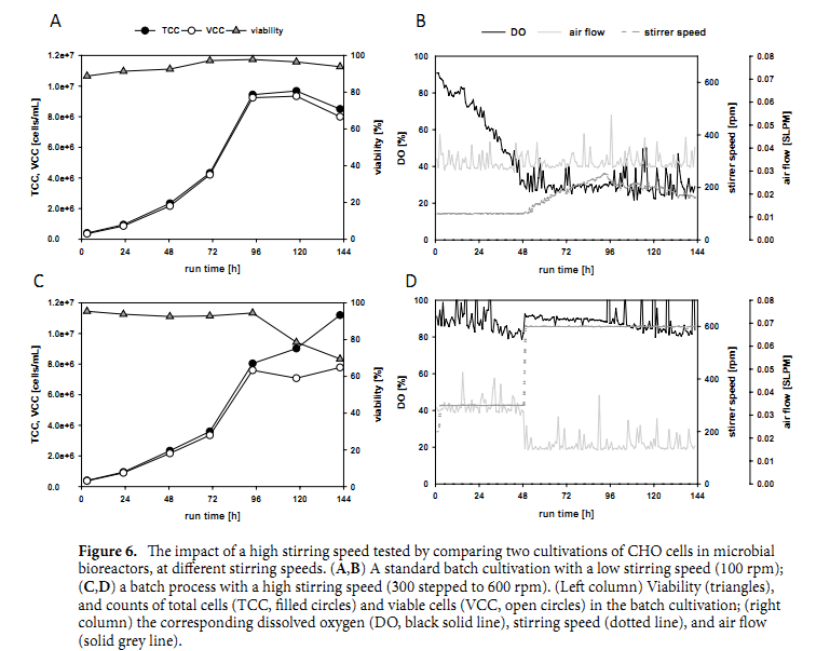
一个生物反应器(图 6A、B)在低搅拌速度下运行,从 100 rpm 开始,曝气速率设置为 0.03 SLPM。通过逐渐增加搅拌速度将 DO 保持在 30%,这模拟了标准的 CHO细胞 分批培养。第二生物反应器以增加的搅拌速度运行。在 200 rpm 的短暂调整阶段后,搅拌保持在 300 rpm,通气速率为 0.03 SLPM。然后,在 48 小时后,搅拌增加到 600 rpm,曝气速率降低到 0.016 SLPM。在两个反应器中,喷雾器向培养基补充二氧化碳以控制 pH 值。通过比较微生物生物反应器中 CHO 细胞在不同搅拌速度下的两种培养来测试高搅拌速度的影响。( A , B ) 低搅拌速度(100 rpm)的标准分批培养;( C , D ) 具有高搅拌速度(300 步进到 600 rpm)的批处理过程。 我们发现细胞生长速率在低和高搅拌设置下几乎相同(图 6 A、C)。此外,在指数生长期间,活力不受高搅拌器速度的影响,在接种后约 96 小时结束。在高搅拌速度,溶解氧勿使其低于80%在整个过程(图 6 d)。我们观察到在稳定阶段的生存能力存在差异;细胞生命力在搅拌速率越快生物反应器中下降速度越快。
研究表明 CHO 细胞可以用 Rushton 叶轮培养,参考文献也显示了这一点。在更高的搅拌速度下,不会损坏细胞。此外,空气流速可以保持在最低水平,并且在整个过程中不需要添加纯氧。较高的搅拌速率和较低的空气流速,在分批培养过程中几乎消除了泡沫;因此,无需添加消泡剂。应用这种修改后的 DO 控制策略可以使 CHO 细胞培养达到更高的细胞浓度。
研究中描述的剪切装置是一种有效且简单的工具,可将定义的剪切水平直接应用于细胞以表征其剪切敏感性。在本研究中,研究人员将剪切装置用于昆虫和 CHO 细胞,但它也可用于其他细胞系、病毒或 VLP,以确定临界剪切应力。通过 Rushton叶轮 动力反应器设计在低空气流速下通过相对较高的搅拌实现的氧气转移率,产生比传统操作模式高得多的细胞密度。此外,这种设置也降低了气体流速并避免了纯氧的应用。研发的控制机制具有提高过程经济效率的优势,但更重要的是,悬浮液中较低的气体体积也减少了液体表面的泡沫形成和气泡破裂。这种现象会对细胞活力、病毒质量和产品(例如 VLP)产生积极影响。




 苏公网安备32059002005708号 技术支持:苏州网站建设
苏公网安备32059002005708号 技术支持:苏州网站建设