4. 体外药物释放和药物泄漏
研究脂质体在不同条件下(如,pH、温度、血浆等)的体外药物释放/泄漏。体外释放方法应具有一定的区分能力。充分考虑脂质体药物的设计目的、应用方式以及预期的用途。建议体外释放研究应达到平台期或释放80%以上的包封药物。
5. 其他
pH 值、脂质体药物的药脂比、脂质体药物混悬液的黏度、无菌、热原和细菌内毒素等。
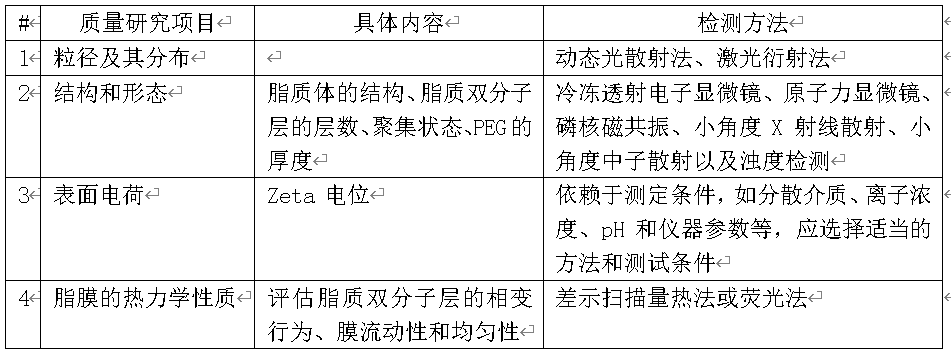
根据质量研究情况,选择关键和常规控制的项目订入质量标准。一般来说,脂质体药物质量标准应包括以下脂质体药物特有的指标。
对于注射用的脂质体,还应包括无菌、热原/细菌内毒素检查;pH 值;装量;渗透压;可见异物;不溶性微粒;残留溶剂等。
四、稳定性研究
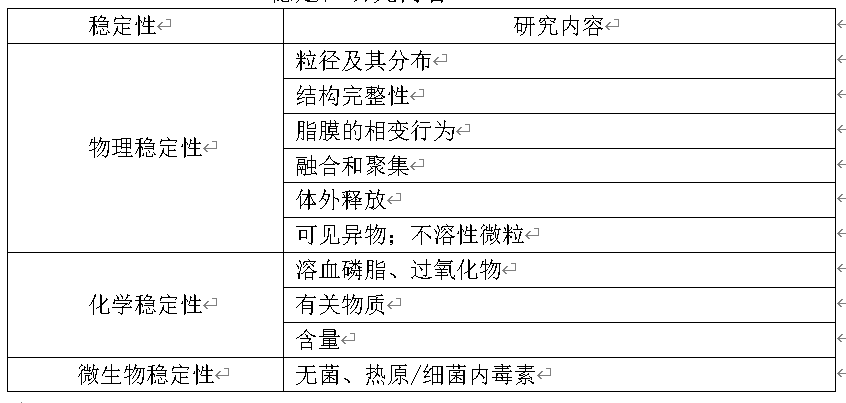
应参考现有指导原则,结合脂质体药物的制剂特征以及产品的设计、应用方式及目标,制订脂质体药物的稳定性研究方案。稳定性研究应阐明脂质体药物的物理、化学和微生物稳定性。一般的稳定性研究内容见下表。
稳定性研究内容
此外,在设计强制降解和加速试验的时候,应注意在接近转相温度或在转相温度之上时,脂质体药品的状态会发生变化。
脂质体药物的稳定性研究还应结合脂质体的剂型、药物装载方式以及临床给药方式来设计。例如,如果拟上市产品是由单独包装的空白脂质体和活性成分组成,稳定性试验应针对单独包装的空白脂质体和药物进行设计,同时还应包括载药后脂质体在使用期间的稳定性。如果在临床使
用前,脂质体药物需要用附带溶剂或其他已批准的药品(例如,大容量基础输液)进行分散重组,应评估分散重组后脂质体药物在使用期间的稳定性。