目前已有三种三代EGFR-TKI药物在国内获批用于EGFR敏感突变晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的一线治疗,分别为奥希替尼、阿美替尼和伏美替尼,其对应的注册研究分别为FLAURA(奥希替尼)、AENEAS(阿美替尼)和FURLONG(伏美替尼)。
三项研究均为多中心、随机、双盲、III期临床研究[1-3],主要入组标准均为ECOG PS评分0/1、EGFR Ex19del/L858R突变的局部晚期或转移性NSCLC患者,同时均允许无症状的脑转移患者入组。作为国际多中心研究,FLAURA将EGFR突变状态(19del/L858R)和种族(亚裔/非亚裔)作为分层因素,针对中国人群的AENEAS和FURLONG则选择了EGFR突变状态(19del/L858R)和基线脑转移(有/无)作为分层因素。研究终点方面,FLAURA和AENEAS选择了研究者评估的无进展生存期(progression-free survival,PFS)作为主要研究终点,FURLONG则选择了独立评审委员会(independent review committee,IRC)评估的PFS作为主要研究终点。
目前三项研究结果全文均已发表,FLAURA率先公布脑转移疗效[4],AENEAS和FURLONG也在2022年美国临床肿瘤学会(ASCO)年会上公布了脑转移患者的独立疗效分析结果[5-6]。回顾三项研究设计,结合已公布的研究数据,仍有几个问题值得大家思考:1.已公布的结果能否作为脑转移亚组的定论?2.研究者评估与IRC评估孰优孰劣?3.针对主要研究终点(PFS)的期中分析是否必要?4.为什么要允许crossover,对结果有何影响?5.对于在进展之前接受新的抗肿瘤治疗(new anti-cancer therapy,NACT)的患者,删失规则该如何定义?本文特邀复旦大学附属中山医院梁斐教授就这5个问题做出初步的解读,供各位读者参考和讨论。
1.已公布的脑转移亚组结果能否作为定论?
国家药品监督管理局药品审评中心(center for drug evaluation, CDE)将亚组分析分为3 种类型,包括:确证性亚组分析、支持性亚组分析和探索性亚组分析(图1)[7],事先定义、多重性调整、检验效能是区别亚组分析类型的3个关键统计学特征[8-9]。为满足确证性要求,需在研究中预设亚组分层随机并同时针对意向性治疗(intent to treat,ITT)原则和特定亚组计算样本量,以保证该亚组具有足够的统计学检验效能,且需采取合适的策略控制总一类错误α。回顾三项研究设计,FLAURA采用序贯多重检验,统计分析顺序为PFS-总生存期(Overall Survival,OS)-亚组PFS,很好地控制了总体I类错误,但其脑转移亚组PFS的结果是在OS分析结果之前公布的[1];AENEAS、FURLONG 则分别进行检验。但三项研究均未针对脑转移亚组计算样本量,缺乏足够的检验效能对脑转移亚组做出确证性结论,因此仅能作为支持性亚组分析。
图1. 亚组分析类型及比较
对于亚组分析结果的可靠性,四川大学孙鑫教授团队提出了9个标准以供参考(图2)[10]。AENEAS和FURLONG将脑转移作为预设分层因素,AENEAS中脑转移患者在阿美替尼和对照组的分布尤为一致(26.2% vs 27.4%),但在亚组结果的可重复性上,阿美替尼和伏美替尼均尚无其他随机对照III期临床研究结果发表,还有待进一步验证。FLAURA则有AURA3研究[11]可供参考,两者在脑转移亚组中分析结果保持一致,虽然两项研究仍存在一定差异,一个是一线研究,一个是二线研究,一定程度上仍有助于提高奥希替尼亚组分析结果的可信度,但FLAURA并未将脑转移作为预设分层因素,导致FLAURA中奥希替尼和对照组的脑转移患者基线均衡不如AENEAS(19% vs 23%),同时基线伴脑转患者占比也低于 AENEAS和 FURLONG。
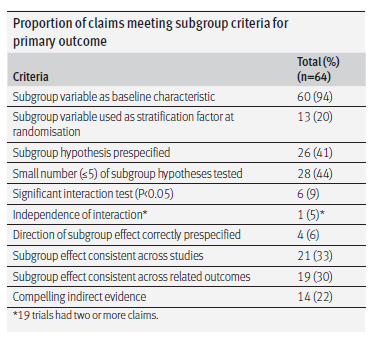
图2. 判断亚组分析结果可靠性的参考标准
综上所述,三项研究的脑转移亚组研究结果均能初步体现各自试验组药物的颅内疗效,可供临床用药时参考,但亚组数据的过度解读并不可取,确证性结果仍需通过针对脑转移人群展开的前瞻性随机对照研究来验证,目前,高剂量阿美替尼对比奥希替尼治疗EGFR突变的晚期NSCLC伴脑转移患者的头对头研究已在进行之中(注册号:NCT04870190)[12]。
2.研究者评估与IRC评估孰优孰劣?
在靶向药物的随机对照注册研究中,使用研究者或IRC评估的PFS作为主要研究终点均是国际上常见且可被监管部门接受的评估方法[13]。
IRC评估通常由独立于各研究中心及试验发起机构的合同研究组织(contract research organization, CRO)来组织承担,多采用盲态独立中心评估(blinded independent central review,BICR)的形式,可以减少因研究者可能对试验组受试者产生倾向获益的预期带来的潜在偏倚或倾向性,一定程度上提高影像评估的独立性和可信度。但IRC评估对于“独立”的严格要求也导致了一系列的困难与不足,其流程与CRO密不可分,巨大的数据量和繁杂的传输、阅片、核查等流程也导致评估的复杂化,例如患者非靶病灶出现进展时,因为临床资料受限、流程耗时,IRC往往并不能及时判断评估,此时单纯依靠IRC评估结果决定患者是否继续接受治疗的设计是有待商榷的。
相较之下,研究者评估虽然可能会增加偏倚的可能性,但更加高效,研究者也会更了解患者的真实情况,能根据患者的状况来评估影像学资料的可靠性,更有利于做出合理的、切合患者利益的评估,这种优势在肿瘤免疫治疗出现假性进展时尤为突出(图3),此时IRC因不能全面了解患者的临床情况,可能难以对患者的治疗效果进行充分评估。
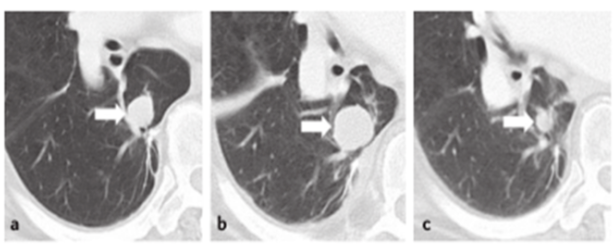
图3. 77岁男性,晚期黑色素瘤患者,接受lpilimumab治疗:(a)基线期CT提示病灶19mm,(b)治疗12周后,CT提示病灶达29mm,与基线相比增大53%,(c)治疗24周后,CT提示病灶缩小至12mm,考虑假性进展可能。
至于研究者评估和IRC评估孰优孰劣,有Meta分析发现,研究者评估和IRC评估对于PFS结果的评估具有高度一致性,相关系数可达0.947(图4)[14]。因此可在选择一方评估结果作为主要终点的同时将另一方作为次要或者进行敏感性分析,两者互相对比、共同构成研究的双保险,并在比较研究者评估与IRC评估结果时可关注风险比(Hazard Ratio,HR)和P值。CDE在《抗肿瘤药临床试验影像评估程序标准技术指导原则(2021年)》中提到,不过度强调IRC与研究者在最终评估结果的一致性,但需监控两者评估结果之间差异的稳定性[15]。在《抗肿瘤药物临床试验统计学设计指导原则(试行)》中也指出“研究者和BICR对疾病进展评估的差异性是PFS分析中的重要问题,对PFS分析时,应常规对此差异性进行分析,并评价其在组间是否平衡”[16]。
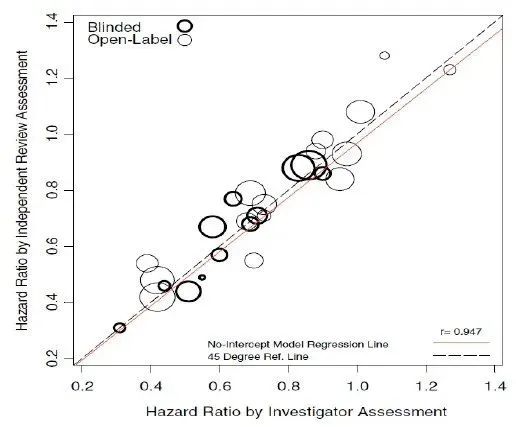
图4. 研究者评估和IRC评估对于PFS结果的一致性分析
根据CDE的《抗肿瘤药临床试验影像评估程序标准技术指导原则(2021年)》,单臂设计的拟支持注册研究当前须采用BICR评估,而在双盲随机对照的大型III期设计的临床试验中,BICR评估并非必须[15]。FLAURA和AENEAS均符合上述非必须要求,在双盲设计下能很好地控制偏倚,将研究者评估的PFS作为主要终点的同时也将IRC评估的PFS纳入次要终点,并对基于IRC评估的结果进行了敏感性分析:在FLAURA和AENEAS中,研究者评估和IRC评估的结果具有很好的一致性,且研究者的中位PFS略好于IRC评估,FURLONG则相反。
表1. 三代EGFR-TKI注册研究中研究者评估和IRC评估的PFS
注:以上结果粗体表示主要终点的分析结果
3.针对主要研究终点(PFS)的期中分析是否必要?
对于是否采用针对PFS的期中分析,三项研究分别采用了不同的设计。AENEAS并没有设立针对PFS的期中分析计划;FURLONG则在观察到117例PFS事件时由独立数据监察委员会(independent data monitoring committee, iDMC)进行了期中分析;而FLAURA在最初的方案中虽然设计了针对PFS的期中分析计划,但最终在FDA的建议下删除,因为“这种分析并不能为支持研究注册提供临床获益的实质性证据”(图5)。

图5. FLAURA研究方案中对PFS期中分析移除的说明
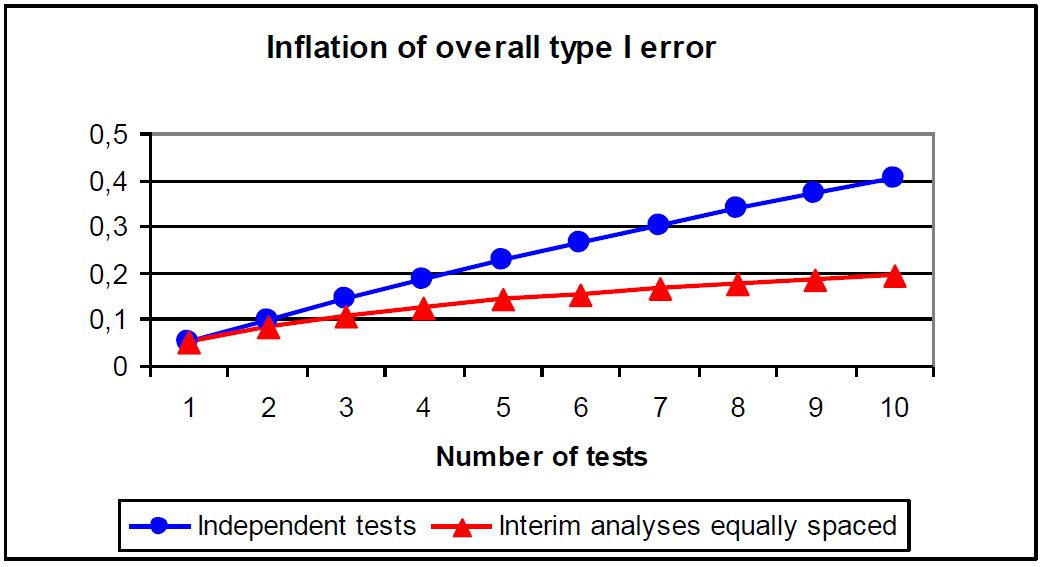
在GCP规范中,期中分析被定义为正式完成临床试验前,按事先制订的分析计划,比较处理组间的有效性或安全性所作的任何分析[17]。那么为什么要进行期中分析呢?一是为了尽早得到研究结果,如果安全性结果有问题,可及时终止、如果有效性结果达到预设终点,也可提前因有效而终止,因此在支持注册的大型III期临床试验中,采用期中分析的试验设计不在少数,如果监管机构认可这种设计,期中分析的数据即可支持注册申请,从而赢得宝贵的上市时间,然而FLAURA最初的期中分析设计最终未能为FDA所认可;二是可用于重估样本量,由于试验设计时先验信息有限,对试验药物的有效性或安全性估计不尽准确,导致样本量的估计也不够准确,期中分析时可以重新估计样本量,计算条件概率或预测概率,确保试验有足够的把握度,FURLONG在设计阶段预计192例PFS事件可检验出组间差异,除计划在观察到119例PFS事件时进行期中分析外,也额外在观察到64例PFS事件(192例的三分之一)时对样本量重新进行了评估,将假设HR由0.647调整为0.688,所需PFS事件也增加至238例。
虽然优秀的期中分析可以为临床试验带来种种好处,但期中分析并不是越多越好,实际上,每进行一次期中分析,即每进行一次假设检验,会使假阳性(false positive)或I类错误率增加,如果每一次期中分析均采用α=0.05的检验水准,那么最后的总体α水平也将随着检验次数而升高,即总I类错误膨胀。如图6所示,假设每次检验是独立的,5次分析之后,总I类错误就会超过20%,这是监管机构无法接受的。因此为了使总I类错误控制在检验水准α(如0.05),则必须校正每一次期中分析的检验水准,常用的检验水准确定方法有Pocock法、O' Brien-Fleming法、Peto法及Lan-Demets消耗函数法等。三项研究中唯一对PFS进行期中分析的FURLONG选择了Lan-Demets法,值得一提的是,虽然FURLONG较FLAURA和AENEAS进行了更多次的PFS分析,但其统计效能选择了80%,低于其余两个研究的90%,也导致FURLONG的样本量相对较小。
4.为什么要允许crossover,对结果有何影响?
FLAURA和AENEAS均在方案中明确规定,允许对照组符合条件的患者在疾病进展之后交叉接受开放的奥希替尼/阿美替尼治疗。FURLONG在方案中无crossover的相关描述,但在全文中提到“数据截止时,有43%的吉非替尼组患者和12%的伏美替尼组患者接受了后续的三代EGFR-TKI治疗”[3]。
那么为什么要有crossover的设计呢?其实在FLAURA启动初期,是不允许crossover的,但随着AURA系列研究的不断成功,奥希替尼已经成为T790M突变患者的标准二线治疗方案,此时再禁止crossover显然有悖于伦理,同时也会增加入组的难度,因此在2015年4月13日,FLAURA修改研究方案并允许对照组符合条件的患者进行crossover(图7)。

图7. FLAURA研究方案中对允许crossover的说明
AENEAS研究事先考虑到研究进行途中阿美替尼二线治疗获批的可能性,在研究设计初期就允许crossover。但允许crossover可能会导致一线获益被二线疗效所稀释,从而使OS没有差异或差异未能达到统计学意义,因此有必要采用合适的统计学处理方法模拟消除crossover影响后的药物真实疗效,如删失法(将转组后的随访时间当做删失处理,偏不保守)、秩保持结构失效模型(RPSFT,对转组后生存时间进行校正)、逆概率删失加权法(IPCW,对未转组概率进行加权),FLAURA在允许crossover的同时也在对OS的统计分析部分进行了预设,如果OS最终分析没有达到统计学差异,将采取这些进行处理校正。
对于AENEAS,根据已公布数据,吉非替尼组有41例(19.1%)患者接受了至少一次阿美替尼交叉治疗,鉴于OS尚未成熟,具体的crossover分析将在后续的发表中进行报道。
5.对于进展前接受新抗肿瘤治疗(NACT)的患者,删失规则该如何定义?
在AENEAS和FURLONG中,对于进展前接受NACT的患者,在主要分析中均将PFS删失到开始NACT前的末次影像学检查日期(图8)。
图8. AENEAS对进展前接受NACT的患者删失规则的定义
FLAURA中则将PFS定义为随机化开始至肿瘤客观进展或死亡之间的时间,无论患者是否停止治疗或在进展前接受NACT,即忽视NACT并继续使用NACT后的影像学数据(图9)
图9. FLAURA对PFS的定义
根据ICH E9(R1)[18],患者进展前接受NACT属于伴发事件的一种,可使用疗法策略或假想策略来解决:疗法策略下伴发事件的发生与定义治疗效应无关,即无论是否发生伴发事件,均会使用相关变量的值,FLAURA继续使用NACT后的影像学数据,即为疗法策略;假想策略则设想一种没有发生伴发事件的情景,体现临床问题的变量值是在所假设的情景下采用的变量值,AENEAS和FURLONG中将NACT后的影像学数据作删失处理,即为假想策略。
通常来说,使用NACT后的影像学数据(疗法策略)会比仅使用NACT前(假想策略)的更为保守,因为此时相对优势缩小。对于AENEAS,因出于伦理原因允许crossover,需考虑未提供额外药物情形下的治疗效应,此时采用假想策略可能更为监管决策所接受。当然,无论采用哪种作为主要删失规则,依然可将另一者作为次要删失规则收集数据进行敏感性分析,探究不同删失规则下的疗效差异。
总结
1.奥希替尼、阿美替尼、伏美替尼在各自的一线注册研究中均在控制NSCLC患者脑转移病灶方面均显示出较好的疗效,但无需过度解读支持性亚组结果,改变临床实践或支持药物说明书撰写仍应经过针对脑转移人群的确证性亚组分析或前瞻性、随机、对照确证性研究来验证。
2.研究者评估与IRC评估各有千秋,可同时纳入研究终点,共同构成研究的双保险,并应重点关注两者评估结果的一致性和稳健性。
3.期中分析可以为后续试验是否能继续执行提供决策依据,其结果可能会对后续试验产生影响,因此,应严格控制期中分析的次数,并选择合适的调整检验水准α的方法。
4.三代EGFR-TKI一线注册研究允许crossover是出于伦理的考虑,可采用合适的统计学处理方法模拟消除crossover影响后的药物真实疗效。
5.对于进展前接受NACT的患者,可根据不同的删失规则要求收集数据进行敏感性分析,探究不同规则下的疗效差异。









 苏公网安备32059002005708号 技术支持:苏州网站建设
苏公网安备32059002005708号 技术支持:苏州网站建设